1.임상검사를 위한 다양한 시료 종류와 솔루션에 대한 이해
- 임상 시험을 위해 필요한 시료 종류로는 혈액, 혈청, 혈장 등이 있고, 또한, 소변, 침과 침, 위에서 분비되는 위액, 그리 고 장기와 같은 조직이 있다.
- 임상 검사에서 가장 많이 사용되는 시료 중에서는 혈청과 소변이 있으며, 이러한 검사가 상당히 많이 활용됨을 알 수 있다.
- 여기에는 이용되는 용액과 농도가 포함된다. 임상 화학을 공부할 때, 이는 매우 기본적이지만 어려운 부분으로 여겨진다.
- 용액은 두 가지 이상의 가스, 액체 및 고체 물질이 균일하게 섞인 혼합물을 의미하며, 20도에서 항상 표준용액이나 처방용액을 준비할 때 이것을 주의 깊게 해야 한다.
2.용매, 용질, 용액 실험
- 용매란 뭔가를 녹여주는 물질을 말하며, 순수한 액체입니다. 일반적인 예로는 물이나 증류수가 있습니다.
- 이용해 녹이는 물질을 용질이라고 하며, 일반적으로 고체입니다. 이는 설탕이나 소금과 같은 물질이 있습니다.
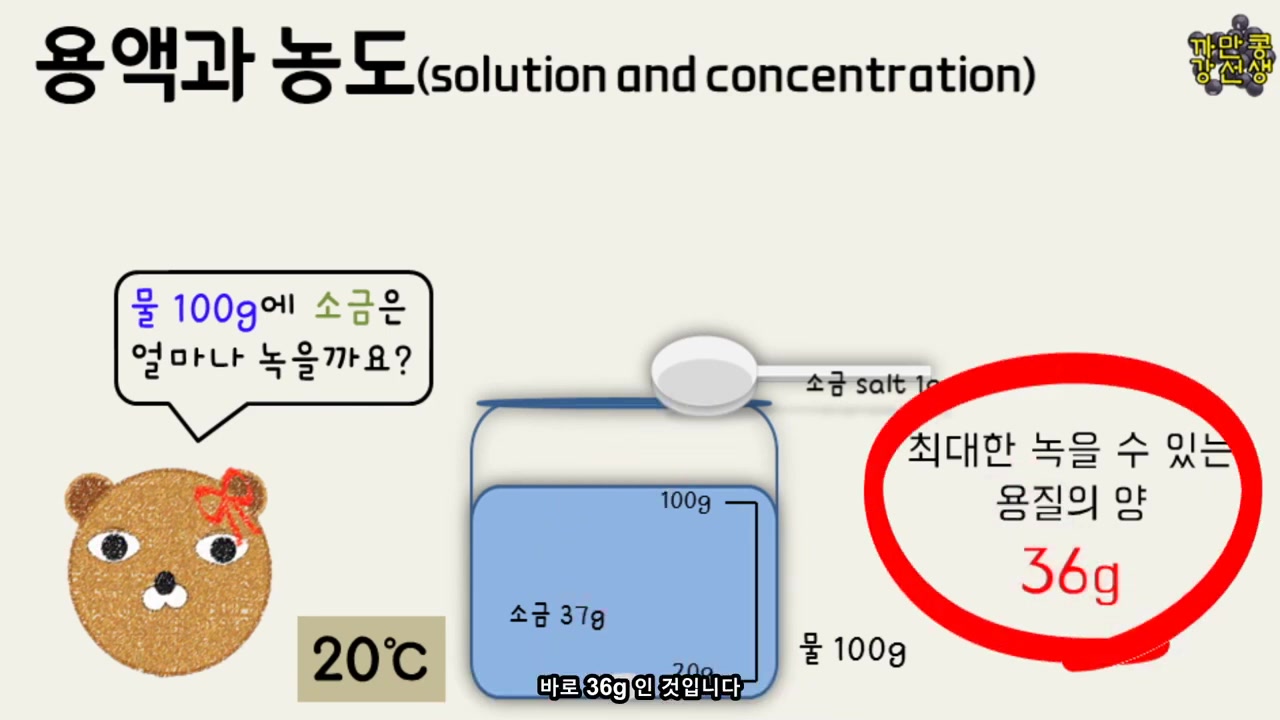
- 이러한 용매와 용질의 혼합물을 용액이라고 합니다. 20도에서 용액을 만들기 위해, 100 G의 물에 얼마나 소금이 녹아들어가는지 실험해보겠습니다.
- 이후 소금을 1g씩 추가하여 녹여보면, 36 G까지 소금이 잘 녹아들어가는 것을 확인할 수 있습니다. 그러나 1g 소금이 추가될 때, 37g이 되며 소금이 갑자기 침전됩니다. 그럼으로써, 가장 많은 양의 소금을 녹일 수 있는 양은 36g임을 알 수 있습니다.
3.용액과 농도에 대한 이해
- 특정 용매(100g의 물)에 최대량의 용질이 용해된 용액을 포화 용액이라고 한다.
- 포화 용액은 일정한 온도와 압력에서 미지의 용리에 용기져 더 이상 용해되지 않는 용액을 말한다.
- 용해도라는 것도 있는데, 이는 용질이 용액에 포화 상태로 용해될 수 있는 한계를 의미한다.
- 퍼센트 용액은 특정물질 또는 용질이 100ml 용매에 용해된 질량이 백분율로 표현된 백분 용액을 말한다.
- 자세히 보면, 180g의 염수를 만들고, 이 물에 20g 소금이 용해되어 있다. 이 경우, 180g의 염수와 20g의 용질 소금을 더하면 된다.
4.수소 분자 개념과 농도 단위 계산
- 수소 분자에 대한 개념을 이해하기 위해, 한 번에 한 문제씩 풀어보자.
- 몰 수(V)는 0.1이고, 용액 L 당 모래 숫자인 M을 고려한다.
- 0.1 M은 100ml 용액이 0.1 L이라는 것을 나타낸다. 따라서 0.1 * 0.1을 계산하면 0.01 몰이 된다.
- 염화 나트륨 수용액의 질량은 0.585 g이다. 이때 질량은 0.585 g로 계산된다.
- 열량용액은 단위가 N이며, 1000ml을 만들기 위해 용매에 용체 용물이 용해될 때의 농도를 나타낸다.
5.️표준 용액과 버퍼 용액의 중요성
- 표준 용액은 농도가 정확히 알려진 용액으로, 주로 순도가 99.98% 이상인 물질을 사용한다.
- 산성 표준 용액에는 잔탄산, 염산, 사구히르산, 칼륨 이중황산 등이 있으며, 이들은 중요한 산성 표준 용액이다.
- 또한, 표준 용액을 용해하는 데 사용되는 증류수, 인산염 버퍼, 시트르산 버퍼는 다음 솔루션으로 나온다.
- 이 외에도 중성, 알칼리성 버퍼 용액이 있으며, 특히 인산 염 버퍼는 중립성을 나타낸다. 탄산 버퍼는 항상 산으로 여겨져 왔지만, 실제로는 9.0 이상의 알칼리성을 갖는다.
6.️단위, SI 접두사 및 이화학 변환공식을 살펴보자.
- SI 단위 접두사를 먼저 살펴보자. 이중에서 이화학 변환공식을 이것을 통해 공식을 통해 등식을 제공하는데, 이를 통해 어떤 유형의 시험이 이 시험을 위한 올바른 시험인지에 대한 문제가 발생한다.
- 따라서요. 이 처럼 환초가 있습니다 이들은 한 뒤에 한다가 어렵고 복잡하여요, 질소 관절의 관절유, 요소낯마 6.25, 요소낯마 2.14, 크레아티니이 1.16 무기, 양은 25, 이런식으로 구성해 놓는 것이 좋다.

임상 시험에서 주로 사용되는 샘플과 솔루션은?

용액 실험 중 왜 항상 20도를 유지할까?
용액 몰농도용액의 특징은?

물 분자 개념을 이해하기 위한 계산?

표준 용액과 버퍼 솔루션의 중요성

단위 변환과 화학식 공식?
'임상병리 국가고시 > 생화학,임상화학' 카테고리의 다른 글
| 전기영동 Electrophoresis 임상화학 총론 (0) | 2021.09.23 |
|---|---|
| 2021 임상병리 국가고시 임상화학 총론 툭!별한 강의 몰(M) 노르말 퍼센트 (0) | 2021.09.09 |
| '효소 저해제' 정확히 알려드리겠습니다 가역적 비가역적 경쟁적 비경쟁적 뜻 (0) | 2021.06.28 |
| 촉매 제?? 생체 촉매?? 과연 다른가?? 효소가 왜 !! 몸에 필요한지 보도록 할게요 효소 요점정리 (0) | 2021.05.31 |
| ammonia 화학식은 바로 NH3 / ammonia 검사법 완벽 분석 정리 (0) | 2021.04.02 |



